
Kimyasal Tepkimeler Konu Anlatımı 8.Sınıf Konu Anlatımları
Nötrleşme tepkimeleri asitlerin ve bazların sulu çözeltileri arasında gerçekleşir. Bu nedenle tepkimede oluşan tuz, çözelti içinde iyonlarına ayrılmış hâlde bulunur. Asit-baz tepkimeleri genel olarak Asit + Baz —-> Tuz + Su şeklinde gösterilir. Asit-baz tepkime denklemlerini yazabilmek için asitlerin ve bazların.

Asit ve Baz (Nötrleşme) Tepkimeleri YouTube
Asit baz tepkimeleri aşağıdaki gibidir; Asit + baz = Tuz + Su şeklinde sonuçlanmaktadır. Asit baz tepkimelerinin denklemlerini sıralamak için asitle ve bazların formüllerinin iyice bilinmesi son derece önemlidir. Bazı asitlerin isim ve formülleri aşağıdaki gibidir: Hidroiyodik asit (HI) Fosforik asit (H3P04) Hidrobromik asit (HBR)

asit baz tepkimeleri YouTube
Bu ünite hakkında: Bu ünitede, asit-baz kimyasında kimyasal dengenin rolü işlenir. pH ve pOH, zayıf asit ve bazlar, tamponlar, asit-baz titrasyonları ve daha fazlası hakkında bilgi edinin. 70'in üzerinde AP uyumlu soru ile öğrendiklerinizi pekiştirin ve AP Kimya sınavına hazırlanın.

ASİT BAZ TEPKİMELERİ Ders izleyin
Asit Baz Tepkimeleri | Kimyasal Tepkimeler ve HesaplamalarVideo anlatımlarda Orbital Yayınları ODAM serisini kullanıyorum. Daha verimli bir ders için almanız.

Asit Baz Tepkimeleri YouTube
Asitler için üç ortak tanım vardır: Arrhenius asit : Solüsyondaki hidronyum iyonlarının (H O ) konsantrasyonunu artıran maddeler . Brønsted-Lowry asit: proton vericisi olarak hareket edebilen herhangi bir madde. Lewis asidi: Bir çift elektronu kabul edebilen herhangi bir madde. Asit Dayanımı ve Kuvvetli Asitler(Asitler ve Bazlar)

11.SINIF KİMYA ASİT VE BAZ DENGELERİNÖTRLEŞME TEPKİMELERİ 32.FÖY YouTube
asit-baz tepkimeleri. asitler ve bazlar bir araya getirildiğinde kimyasal tepkime meydana getirirler. Bu kimyasal tepkime sayesinde asidin asidik özelliği, bazın da bazik özelliği azalır. Meydana gelen olay bir kimyasal değişim olduğu için tepkimeye giren asit ve baz kendi özelliğini kaybeder. Genellikle asit-baz tepkimeleri sonucunda tuz ve su oluşur.

Zayıf Asit Zayıf Baz Tepkimeleri (Kimya) YouTube
0:00 / 15:25 90) TYT-Kimya - Asit Baz Tepkimeleri -Görkem ŞAHİN (2022) Benim Hocam 2.68M subscribers Subscribe 7K 214K views 1 year ago 2022 TYT Kimya Konu Anlatımı - Görkem ŞAHİN Türkiye'nin.

ASİT BAZ TEPKİMELERİ 4D10 SINIF TYT YouTube
Asit-baz tepkimeleri ekzotermik (ısı veren) tepkimelerdir. Bir örnek tepkimeyle nötralleşme tepkimesinin nasıl meydana geldiğini inceleyelim. Asit-baz tepkimelerinde nötralleşme olayı titrasyon düzeneği hazırlanarak takip edilir. Asit üzerine baz, baz üzerine asit eklenmesiyle meydana gelen değişimler düzenekte gözlemlenir.
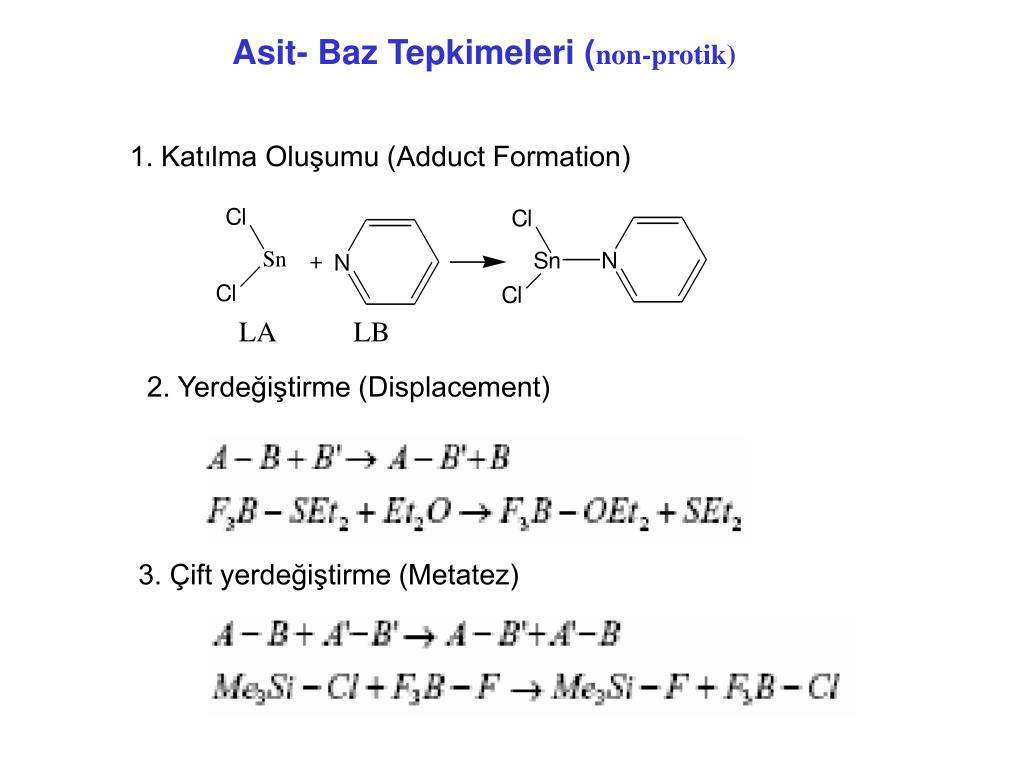
PPT Asit Baz Tepkimeleri ( nonprotik) PowerPoint Presentation, free
Asitler, Bazlar ve Tuzlar Çevremizdeki pek çok maddeyi ortak kimyasal özelliklerine göre gruplandırabiliriz. - Asitler, bazlar ve tuzlar bu Folik asit gruplardan üçünü oluşturur. Asitler Asit kelimesi latince "ekşi" anlamına gelir. Ekşi tat veren maddeler asit özelliğine sahiptir. limonda sitrik asit elmada malik asit

Özel Beyza Şensoy Okulları 10.sınıf Kimya Asit ve Baz Tepkimeleri YouTube
Asit-Baz Tepkimeleri Zayıf Asit - Kuvvetli Baz Tepkimeleri Google Classroom Daha Fazla Bilgi Zayıf bir asitle kuvvetli bir baz karıştırıldığında, şu net iyonik denklemin tanımladığı şekilde tepkimeye girerler: HA (suda) + OH⁻ (suda) → A⁻ (suda) + H₂O (s).

10.Sınıf AsitBaz Tepkimeleri Konu Anlatımı Tonguç Akademi
Asit ve Baz Tepkimeleri Örnekleri. Asit-baz tepkimelerine örnek olarak şu tepkimeleri verebiliriz: HCl + NaOH → NaCl + H2O. Bu tepkime, hidroklorik asit ve sodyum hidroksit arasındaki tepkimedir. Bu tepkime sonucunda sodyum klorür (NaCl) ve su (H2O) oluşur. H2SO4 + Ca (OH)2 → CaSO4 + 2H2O.

10.Sınıf Tepkime Denklemlerinin Denkleştirilmesi Konu Anlatımı Tonguç
Zayıf asit ve baz iyonlaşma tepkimeleri ve ilişkili denge sabitlerini, Ka ve Kb'yi, Ka ve Kb'yi pH ile ilişkilendirmeyi ve yüzdelik ayrışmayı hesaplamayı öğrenelim. Önemli noktalar: Genel monoprotik zayıf bir asit HA ile eşlenik baz A − için denge sabiti aşağıdaki gibi ifade edilebilir:

Asit ve Baz (Metal) Tepkimeleri YouTube
Asit-baz tepkimesi, bir asit ile bir baz arasında meydana gelen kimyasal tepkimedir.Tepkime mekanizmalarının açıklanması ve bu mekanizmalar kullanılarak ilgili problemlerin çözülmesi amacıyla bu tür tepkimelere dair teoriler geliştirilmiştir; bunların önde gelenleri arasında Brønsted-Lowry asit-baz kuramı bulunur. Bu konudaki ilk teori 1776 yılında Fransız kimyager.

Kimyasal Tepkimeler ve Asit Baz Tepkimeleri 1) 16 gra... Kimya
Zayıf bir asit, zayıf bir bazla karıştırıldığında, şu denklemi takip ederek denge durumuna gelirler: HA (suda) + B (suda) ⇌ A⁻ (suda) + HB⁺ (suda). Denge durumu, zayıf asitle zayıf bazın tarafına daha yakındır ve sonuç olarak elde edilen çözeltinin asidik mi, bazik mi yoksa nötr mü olduğunu türlerin Ka ve Kb.

Brönsted Lovry Asit Baz Tanımı . EşlenikKonjuge Asit ve Baz Çiftleri
Mutfağınızdaki sirkeden tutun duştaki sabuna kadar, asit ve bazlar her yerdedirler! Ama bir şeyin asidik ve ya bazik olması ne demektir? Bu soruya cevap vermek için asit ve bazları tanımlayan teorileri incelememiz gerekiyor. Bu makalede Arrhenius teorisine odaklanacağız. Arrhenius asitler

Asit ve Bazların Metallerle Etkileşimi Kimya Bilimi
Bir maddenin asit mi baz mı,asit ve baz ise ne kadar kuvvetli ne kadar zayıf olduğunu anlamamıza yarayan maddelere İndikatör. Asitlerin Karbonatlı bileşiklerle tepkimeleri C Asitler Karbonat içeren tuzlar ile tepkimeye girebilirler. Bunun sonucunda tuz ve su ile birlikte C0 2 gazı oluşur. CaCO 3(k) + 2HCl(aq) à CaCl 2(aq) + CO 2.